今回、当会にご賛同いただいている薬学博士の堀内有加里さんに、薬やワクチンの開発の流れと新型コロナワクチン特例承認の問題点について寄稿をお願いしました。
堀内さんは、薬剤疫学、医薬品安全性監視、医薬品情報学がご専門なので、基本を抑えながら、新型コロナワクチンの異例の状況についても解説してくれています。
以下、寄稿いただいた内容になります。ぜひ、ご覧ください。
※画像はクリック、タップすると拡大してみてもらえます。
薬やワクチンの基本的な開発の流れ
市民審議会のホームページをご覧の皆様、初めまして。堀内有加里と申します。
本会の活動理念に共感賛同させていただき、これまでに何度か交流会にも参加させていただいておりますが、まずは簡単に自己紹介をさせてください。
堀内有加里さんプロフィール

私は、大学院生の頃から医薬品等の効果や安全性の評価について興味を持ち、これまで20年程、医薬品情報学、薬剤疫学分野の研究に関わってきました。
現在は、医師や研究者、製薬企業が既存の医薬品に関する疫学研究を実施する前に、研究デザインが適切か?データの保管方法は適切か?研究に参加する対象者に不利益や苦痛を与えることはないか?などをチェックする倫理審査員をしています。
薬剤疫学とは、医学、薬学、看護学、疫学、統計学、医薬品情報学、公衆衛生学、経済学などが関係する学際的領域で、様々な観点から「ヒトの集団における市販後の医薬品等の使用とその効果や影響を総合的に研究する」分野です。
どんな医薬品やワクチンもリスクはゼロではありません。
薬剤疫学研究は、人々の健康を維持し、人々がより安全に薬物治療を受けられるように、医薬品やワクチンの有効性と安全性を評価し、その効果を最大化しリスクを最小化する役割を担っています。
今回は、薬やワクチンの開発が始まってから動物実験や臨床試験を経て、承認・販売されて多くの人に使われるようになるまでの基本的な流れと、新型コロナワクチンの開発の経緯や承認についてお話しさせていただきたいと思います。
皆さんは、通常、薬やワクチンの開発から承認までにはどれくらい時間がかかるかご存じでしょうか?
図1に示すように、医薬品等の候補が見つかってから非臨床試験(動物実験)、臨床試験(治験)が終了するまでに平均して約20年もかかるのです。それでも科学技術の発展によりひと昔前に比べてかなり短くなりました。

医薬品開発における治験の流れ
製薬会社で開発中の「薬やワクチンの候補」を健康な成人や患者を対象として有効性や安全性を確認する目的で実施される臨床試験を特に「治験(治療試験の略)」と呼び、治験で使われる「薬やワクチンの候補」を治験薬と呼びます。
承認前の臨床試験は第1相から第3相まで実施されますが、第1相試験では、ヒトにおける安全性と治験薬の体内動態(吸収、分布、代謝、排泄や血中濃度など)が確認されます。ここで、治験薬をヒトに対して初めて投与することになります。
どんなに動物実験で安全性が確認されていたとしても、ヒトにおける安全性が未確認なので、通常は、妊娠の可能性のある女性を避けて、極少数の健康な成人男性を対象に実施されます。
女性のみが使用する医薬品開発の場合は、女性を対象として実施されますが、妊娠への影響が分からないので基本的には閉経後の女性が対象となります。
抗がん剤などの作用が強い薬の場合は健康なヒトであっても害を及ぼす可能性があるため、初めからがん患者が対象になることもあります。小児に使われる医薬品開発の場合も同様です。
第1相試験で安全性が確認された後、第2相試験で初めて少数の患者が対象とされて、患者における安全性を確認します。
第2相試験では、第1相試験で安全性が確認された用量の範囲内で徐々に用量を増やしたり、投与期間や間隔を変えたりして有効性を確認し、最も有効な用法・用量が決定されます。
第2相試験で有効性・安全性が確認された後、より詳細な情報を収集し、第2相試験の結果を検証する目的で第3相試験が実施されます。
第3相試験は、実際の治療での使用により近い形でより多くの患者に治験薬を投与して、既存の薬あるいはプラセボとの比較が行われます。実際の治療現場での使用を想定しているため試験期間が半年以上になることもあります。
このように臨床試験での対象者は特定の限られた集団なので、基本的に高齢者や妊婦や授乳婦、治験薬が使われる予定の疾患以外の疾患を同時に持っている人は含まれません。
また、限られた期間で実施されるため、医薬品等が数年に渡って使用される場合の中長期の安全性を確認することはできないのです。
しかしながら、リアルワールドでは、複雑な条件のもとに様々な人々に使われます。ですから、残念ながら臨床試験の結果だけでは薬やワクチンの安全性を完全に把握することはできないのです(図2)。

第3相試験が終了すると、その治験薬に関する非臨床試験と臨床試験のすべての膨大なデータを医薬品医療機器総合機構(PMDA:Pharmaceutical and Medical Devices Agency)という機関で、半年から2年ほどかけて承認審査されます。
PMDAでの審査結果が厚労省に提出され、審議会で薬事承認が認められると、ようやく市販されますが、前述したように臨床試験の結果だけでは薬やワクチンの安全性を完全に把握することはできないので、市場で使われるようになった後も再審査期間が設けられていて安全性確認のための調査が継続して実施されます。
ですから、新しい薬やワクチンを使用する際には、既存のものと同じと考えずに、慎重に判断してほしいと思います。
医薬品とワクチンの治験における試験項目の違い
さて、医薬品やワクチンの開発における非臨床試験/臨床試験には、法律やガイドラインによって実施しなければならないとされる試験項目が定められているのですが、医薬品とワクチンでは内容が異なっています。
ワクチンの非臨床試験の試験項目に関しては「感染症予防ワクチンの非臨床試験ガイドライン」により決められており、医薬品では必須とされていてもワクチンでは必須とされない項目があります。
従来のワクチン(生ワクチンや組み換えワクチンなど)は、毒性を除いたウイルスや細菌の全部または一部を接種し、ウイルスや細菌そのものに対するヒトの免疫反応を利用して抗体を作るので、ウイルスや細菌そのものの体内動態を確認するのが困難なことや、通常は接種回数が限定されていることなどから、遺伝毒性やがん原性に問題はないと考えられているためです(図3)。

同様に、ワクチンの臨床試験でも医薬品では必須とされていてもワクチンでは必須とされない項目があります。
前述したような理由から、薬物動態試験は必要とされていませんし、感染予防効果やウイルスの伝播予防効果を実証するのが困難であることから、発症予防効果や免疫原性や抗体価での評価を実施することになっています(図4)。

新型コロナワクチンの開発から臨床試験、承認までの流れの確認
ここで、新型コロナワクチンの開発から非臨床試験/臨床試験、および承認について確認してみましょう。
ファイザー社及びモデルナ社のワクチンはメッセンジャーRNA(mRNA)ワクチンと呼ばれ、ウイルスの一部であるスパイクタンパク質の遺伝子情報(設計図)であるmRNAをLNPという脂質の膜に包んだワクチンです。
mRNAワクチンをヒトに注射すると、ヒトの身体の中でウイルスのスパイクタンパクが作られ、それに対する抗体が産生されたり細胞性免疫応答が誘導されることで、ウイルスに対する免疫ができると考えられています。
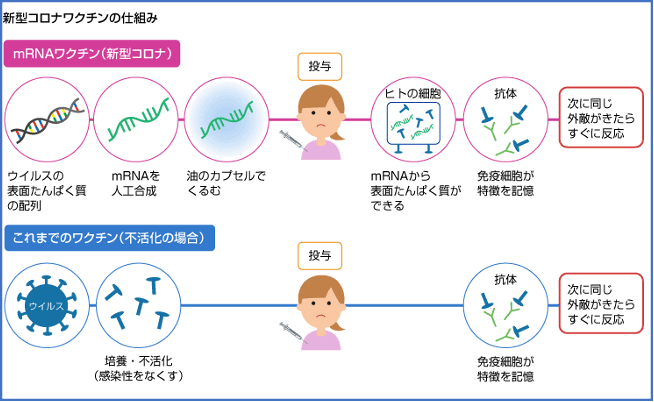
図5の出典:nikkei4946.com
このmRNAワクチンは、これまでのワクチンとは異なる作用機序を持つワクチンであり、人類史上はじめて多くのヒトに使われるワクチンです。
mRNAの技術を医薬品やワクチンに応用する研究は1990年に開始され、様々な失敗や成功を繰り返し、実用化されるまでに約30年を要していますが、新型コロナウイルスが発見されてからワクチンとして市場に出るまでに要した時間はたった1年です。

つまり、図1に示したような安全性を確認するための十分な臨床試験が実施されていないのです。
さらに、新型コロナワクチンは、「ワクチン」という枠組みで非臨床試験/臨床試験を実施しています。ワクチンとして使用されることを念頭に置いた治験であるため、当然ながら、図3にあるように通常の医薬品では必須とされている試験が実施されていません。
そのため、新型コロナワクチンのインタビューフォーム(医薬品やワクチンの開発の経緯や基礎実験、臨床試験データの詳細、用法用量、製剤の保管方法や耐性試験に関する情報がまとめてられている冊子)の「非臨床試験に関する項目」の薬理試験や毒性試験、「薬物動態に関する項目」の多くの試験項目では、試験が実施されていないためデータが掲載されていません(図7~9)。



ワクチンという枠組みのため、これらの試験項目を実施していなくてもルール上は問題ありません。
懸念される症例報告、研究結果が発表されている
しかしながら、最近になって、これらの項目について懸念される症例報告や研究結果が相次いで発表されるようになってきました。
特に、図9にあるように、「該当資料なし」(試験が実施されていない)と記載されている血液―脳関門通過性や乳汁への移行性に関して、3回目の新型コロナワクチン接種から3週間後に死亡した76歳の男性の心臓や脳からワクチン由来と考えられるスパイクタンパクが検出されたという症例報告1)や乳児への曝露は確認されなかったものの、授乳中にワクチンを接種した母親の乳汁中にワクチン由来のmRNAが検出されたという研究結果2)が報告されています。
脳や母乳に移行したワクチンの成分やワクチン由来のスパイクタンパクが、接種した本人や母乳を飲んだ乳児にどのような影響をもたらすのかについてはさらなる研究が必要ですが、健康被害が全くないとは言い切れません。
加えて、新型コロナワクチンは緊急時であることを条件に、「特例承認」されています。
特例承認とはどんな制度?
特例承認とは、簡単に言うと、海外で使用実績があれば承認時点で必ずしも日本人での有効性・安全性を確認する必要はなく、第2相試験までの有効性と安全性が確認されれば、第3相試験の結果を待たずに承認できる制度です。
特例承認では、GMP省令(Good Manufacturing Practice:医薬品及び医薬部外品の製造管理及び品質管理の基準に関する省令)に基づいた製造所で遵守すべき製造管理・品質管理の基準を満たしているかについての調査が完了していなくても承認可能なので、品質管理に関しても不十分です。
そのため、今回の新型コロナワクチンに関して異物の混入や、品質の均等性について疑義が生じています。通常承認であれば、製造所がGMP省令を遵守していなければ、医薬品の製造販売は認められません。また、容器包装についても製品ラベルが日本語でなくても承認できるので、医療機関での十分な確認が必要となります。

新型コロナワクチン特例承認に関わる問題点
有事や未知の感染症流行などの緊急時におけるワクチンや医薬品の特例承認/緊急承認全てを否定するわけではないですが、以下の点について、私は非常に問題があると考えています。
緊急時とは具体的にどんな状況を指すのか?
新規の感染症が流行した場合どの程度の感染状況を緊急時とするのか?
特例承認/緊急承認可とするための最低限の条件として、どの程度のベネフィットでどの程度までのリスクを許容するのか?
緊急事態の解除の条件は?
緊急事態を乗り越えた後、どの時点で見直すのか?
これらの点に関して、公衆疫学的な観点を盛り込んだ具体的な指針が示されておらず、曖昧なままです。
まとめ
これまでお話ししてきたように、通常の承認であっても医薬品等の安全性を完全に把握することはできません。新型コロナワクチンは特例承認されたワクチンですので、通常の承認よりもさらに安全性の確認が不十分であり、中長期に起こり得るリスクに関しては全くデータがありません。
それにも関わらず、一部の政治家やワクチンを推奨する医療関係者や専門家と呼ばれる方々は「安全だ」と言ってきました。
新型コロナワクチンはこれまでとは全く異なる機序のワクチンであり、さらに人類に対して初めて使用するタイプのワクチンですから、ワクチンという枠組みに拘らず、医薬品と同様の動物実験や臨床試験を実施して、慎重に安全性を確認すべきではないかと思っています。
現在、国内外で新型コロナワクチンによる副反応疑い症例が数多く報告され、学会等で具体的な症例報告が発表されるようになってきました。
このような状況においても国は依然としてワクチン接種を推奨していますが、一度立ち止まり、副反応に関して丁寧な調査や検証を行い、現時点で明らかになっているリスクや今後起こり得るリスクについても公正公平に分かりやすく国民に伝えるべきではないでしょうか。
参考文献:
1) A Case Report: Multifocal Necrotizing Encephalitis and Myocarditis after BNT162b2 mRNA Vaccination against COVID-19. Michael Mörz. Vaccines 2022, 10(10), 1651; https://doi.org/10.3390/vaccines10101651.
2) Neutralizing Activity and SARS-CoV-2 Vaccine mRNA Persistence in Serum and Breastmilk After BNT162b2 Vaccination in Lactating Women. Yeo et al. Front Immunol. 2022; https://pubmed.ncbi.nlm.nih.gov/35087517/
編集者後記
市民審議会の片岡です。堀内さんには、定期的に寄稿をいただくようにお願いしております。また、こちらで開催しているオンライン交流会にもご参加いただけることも多いです。
質問や直接繋がりたいという場合は、オンライン交流会もご活用ください。
12月のオンライン交流会 開催情報
【オンライン意見交換会&交流会】
日 時: 2022年12月7日(水) 21時~22時(22時30分頃までルーム空けてます)
募集対象:全国の署名賛同者&市民審議会のフォロワー
募集人数:定員50名(※顔出しできる人)
方 法: ZOOM
・中村篤史先生Facebook
・中村篤史先生のnote
お申し込みは下のボタンからお願いします。
倫理審査員であられる堀内さんの投稿は貴重で大変参考になりました。 今回の件は、全て分かっていて政治利用された感がいがめません。 倫理委員会の組織としての機能も世界的な流れに組み込まれていかないか危惧しております。 本来の趣旨に沿った内容の配信が広く周知されますことを願います。